ОПИСАНИЕ
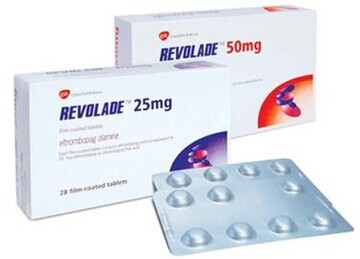
Revolade 25 мг является
рецептурным лекарством, которое используется под наблюдением врача.
Препарат Револаде 25 мг можно использовать в составе комбинированной
терапии. Таким образом, лекарство может потребоваться с другими
лекарствами
ПОКАЗАНИЯ
Revolade 25 мг таблетка показана в основном для лечения пациентов, у которых:
• Снижение уровня тромбоцитов из-за хронической иммунной тромбоцитопении
• Снижение количества тромбоцитов из-за хронической инфекции вирусом гепатита С
• Тяжелая апластическая анемия:
• Лечение передний край тяжелой апластической анемии.
• Лечение тяжелой апластической рефрактерной анемии.
МЕХАНИЗМ
Revolade 25 мг является частью класса лекарств, называемых агонистами рецепторов тромбопоэтина (ТПО). Классификация лекарств – это объединение лекарств, которые работают аналогичным образом. Эти лекарства часто используются для лечения подобных состояний. Revolade работает, поднимая клетки в костном мозге и заставляя эти клетки производить несколько тромбоцитов. Этот эффект снижает риск кровотечения.
Продвигай меня
поглощения:
Максимальная концентрация в плазме составляет от 2 до 6 часов.
распределение:
Связывание с белками плазмы с высоким содержанием человека составляет> 99%, а в плазме крови – от 50% до 79%.
метаболизм:
Он преимущественно метаболизируется путем расщепления, окисления и конъюгации с глюкуроновой кислотой.
исключение:
Revolade 25 мг выводится в основном через стул 59%, а 31% через
экскреция
Почечный Период полураспада здоровых пациентов Revolade 25 мг составляет от 21 до 23 часов, а идиопатическая тромбоцитопеническая пурпура составляет от 26 до 35 часов.
ДОЗИРОВКА
Хроническая иммунная тромбоцитопения:
- Показан только у пациентов с хронической иммунной тромбоцитопенией, чье клиническое состояние повышает риск кровотечения
- Inicial: 50 мг PO qDay
- Отрегулируйте дозу для достижения и контролировать количество тромбоцитов (Plt)> 50 x 10 ^ 9 / л, чтобы уменьшить риск кровотечения; не превышать 75 мг / сут. Тромбоцитопения, связанная с хроническим гепатитом С
- Inicial: 25 мг PO qDay
- Доза до 25 мг вместе с 2 PRN Revolade 25 мг для достижения цели Pltneeded для начала / контроля противовирусного лечения пегилированным интерфероном и рибавирином; Не превышать 100 мг / сут.
- Во время противовирусной терапии отрегулируйте дозу, чтобы остановить снижение дозы пегинтерферона
Тяжелая апластическая анемия
- Первая линия терапии:
- Совместное применение со стандартной иммуносупрессивной терапией для пациентов с тяжелой апластической анемией (SAA)
- Обычная доза: 150 мг PO qDay на 6 месяцев
- Не давайте больше стартовой дозы; общая продолжительность 6 месяцев
SAA рефрактарио:
- Лекарство, назначаемое для этого состояния, которое не реагирует в достаточной мере по крайней мере на 1 перед иммуносупрессивной терапией
- Обычная доза: 50 мг в день.
- Отрегулируйте дозу до 50 мг аккреции q2 eltrombopagPRN, чтобы достичь целевой Plt ≥50 x 10 ^ 9 / л при необходимости; не превышать 150 мг / сут; Может потребоваться до 16 недель для гематологического ответа.

ВТОРИЧНЫЕ ЭФФЕКТЫ
Общие побочные эффекты:
- низкие красные кровяные клетки
- тошнота
- лихорадка
- слабость
- головная боль
- тос
- снижение аппетита
- схватывание
- Диарея.
Серьезные побочные эффекты:
- Моча в темном цвете.
- Пожелтение вашей кожи.
- Отек живота
- путаница
- Боль в груди
- диспноэ
- облачное зрение
- Светочувствительность
- Смотрите круги вокруг огней.
- Отек ног
ВНИМАНИЕ
- Препарат Revolade 25 мг таблетка вызывает состояние предупреждения, вызовите доктора, когда есть новое взаимодействие с лекарством. Предупреждение о прогрессировании заболевания: избегайте использования лекарств, в то время как у пациентов есть миелодиспластический синдром (MDS), так как это увеличит риск смерти.
- Если другие факторы риска для тромбов, то избегайте eltrombopagлекарства, потому что это увеличит количество тромбоцитов и тромбов.
- Если у пациентов есть катаракта, избегайте приема лекарств из-за их воздействия и ухудшайте состояние.
ВЗАИМОДЕЙСТВИЕ НАРКОТИКОВ
- Revolade 25 мг таблетка с этими препаратами эзетимиб, глибурид, олмесартан, репаглинид, валсартан, иматиниб, иринотекан, лапатиниб, метотрексат, митоксантрон, бозентан, сульфасалазин и топотекан иринотекан приводит к усилению побочных эффектов. Таким образом, доктор может уменьшить дозу этих лекарств, если это необходимо.
- Revolade 25 мг таблетка с препаратами, снижающими уровень холестерина, такими как аторвастатин, флувастатин, розувастатин, правастатин и симвастатин, питавастатин. Наличие высоких побочных эффектов может содержать мышечные боли. Доктор может уменьшить дозу ваших лекарств от холестерина.
- Revolade 25 мг сопутствующей с антацидами, витаминами или добавками, содержащими Ca, Al, Fe, Se, Zn или Mg. Чтобы прекратить взаимодействие, примите Revolade за два часа до или через четыре часа после приема любого из этих продуктов.
БЕРЕМЕННОСТЬ
- Категория беременности – C Используйте Revolade 25 мг с осторожностью, если актив перевешивает риски. Исследования на животных показывают риски и человеческие исследования не Eltrombopagдоступны или не были изучены у животных или людей.
BREASTFEEDING
Присутствие Revolade 25 мг или метаболитов в материнском молоке, препарат имеет возможные серьезные побочные эффекты для ребенка на грудном вскармливании. Препарат не рекомендуется при кормлении грудью.
ХРАНЕНИЕ
- Хранить при комнатной температуре 20 ° и 25 °.
- Откажитесь от пропущенного лекарства, если оно не используется в течение 30 минут
Пропущенная доза
В случае пропуска дозы пациенты должны проконсультироваться с врачом и следовать инструкциям, данным ими. Таким образом следует избегать пропущенной дозы и следовать регулярному графику дозирования.
Наши контакты
телефон:
+91
(998) 7711567
+58 (412) 5815903
Эл. адрес :
applepharmaceutical@gmail.com